Les aventures françaises du cannabis médical (suite)
Chère lectrice, cher lecteur, vous arrive-t-il de fouiner dans Légifrance, le site officiel du gouvernement français pour la diffusion des textes législatifs et réglementaires ? Non ? Eh bien vous avez tort, comme le montre la belle histoire du cannabis médical en France et son dernier épisode, le Sativex®1.
L’article R.5181 du 28 novembre 1956 du CSP interdit toute utilisation du cannabis à des fins médicales. Cette date ne doit rien au hasard : c’est l’année où le Maroc acquiert son indépendance. Deux ans auparavant, la Régie française des kifs et tabacs créée en 1906 et qui, pendant un demi-siècle a promu et vendu du kif au Maroc, disparaît. Il n’est donc plus interdit d’interdire… le cannabis !
THC de synthèse
Cette version de l’article ne sera modifiée que le 31 décembre 1988 puis quatre autres fois jusqu’à la version du 8 août 2004. En effet, en juin 2001, Bernard Kouchner, qui avait fait de la lutte contre la douleur un axe fort de sa politique, annonce qu’il est favorable aux utilisations médicales du cannabis et des cannabinoïdes et charge l’Afssaps (Agence française de sécurité sanitaire des produits de santé) du dossier. Que se passe-t-il alors ? Une nouvelle version de l’article, en date du 8 août 2004, est alors rédigée. Le diable se cachant dans les détails, ce texte interdit toujours le cannabis et ses dérivés à des fins médicales mais, et c’est la nouveauté, à l’exception du THC de synthèse. Le détail, c’est « de synthèse ».
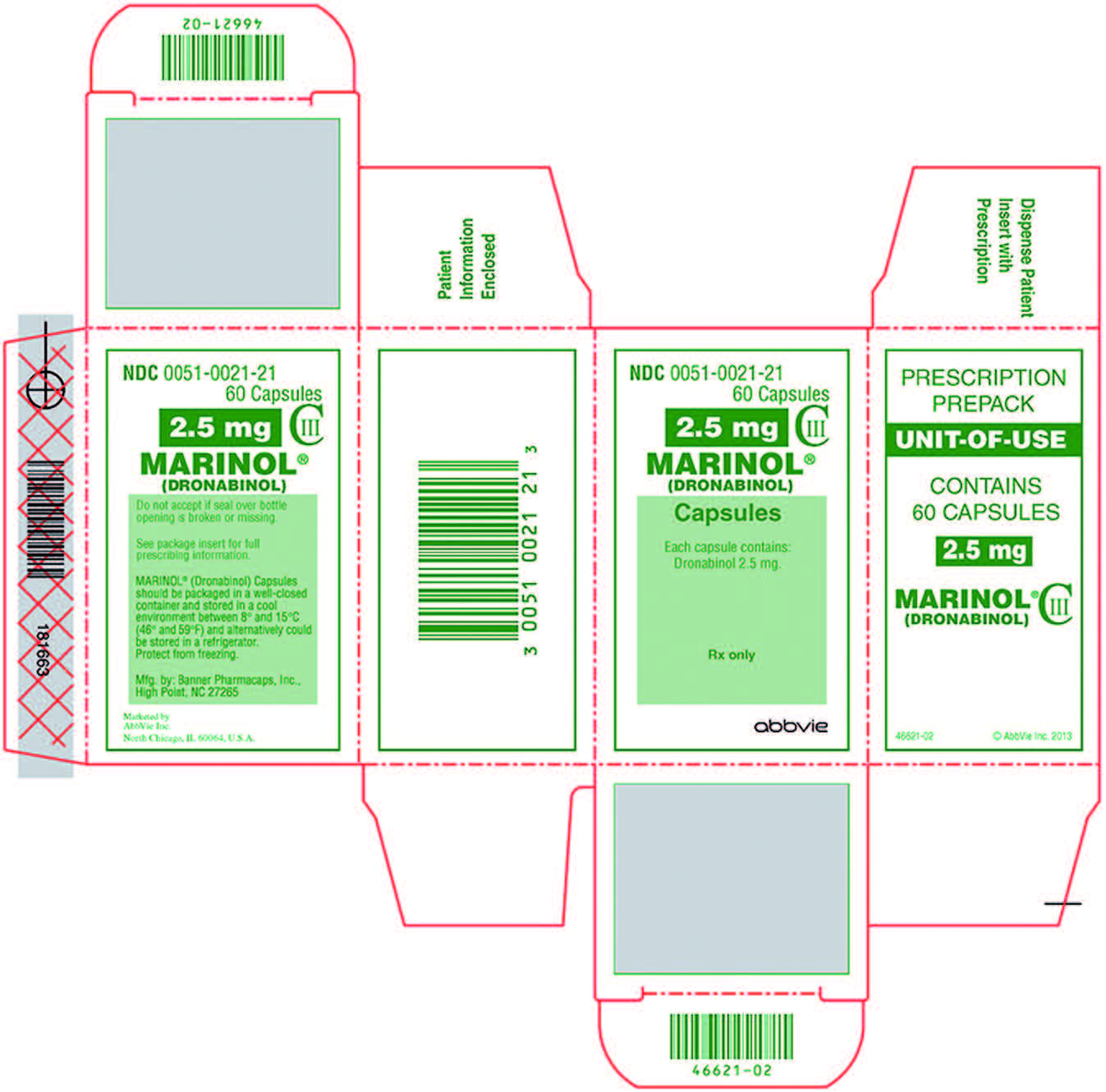
L’Afssaps met alors en place une Autorisation temporaire d’utilisation (ATU) pour le Marinol® (dronabinol), un THC de synthèse précisément, qui se présente sous la forme de gélules dosées à 2,5 mg, 5 mg et 10 mg. Habituellement, une ATU concerne des médicaments qui n’ont pas encore d’Autorisation de mise sur le marché (AMM) mais qui pourraient déjà être utiles à certains patients. Ainsi, dans le cadre du sida, où les avancées thérapeutiques sont constantes, de nombreux médicaments disposent d’ATU « de cohorte », c’est-à-dire pour un nombre plus ou moins important de patients. Mais il existe une autre ATU, bien plus contraignante, l’ATU dite « nominative » : après examen du dossier concernant un seul patient et pour une période limitée, l’Afssaps donnait ou ne donnait pas d’autorisation.
Il y avait deux manières de mettre en œuvre cette ATU nominative. La première aurait consisté à donner un minimum d’informations sur son existence aux médecins hospitaliers, seuls habilités à prescrire, et aux pharmaciens hospitaliers, seuls habilités à délivrer. À élaborer et rendre publique une liste de maladies dont cette ATU pouvait éventuellement relever. À faciliter, autant qu’il était possible, le travail des prescripteurs tant ces dossiers d’ATU nominative sont chronophages.
Une centaine d’ATU nominatives
C’est l’exact contraire qui fut fait : absence de publicité, opacité des décisions (souvent négatives), demandes concernant les médicaments dont le patient avait déjà bénéficié, voire de bibliographie justifiant l’indication. Autant dire que le dispositif visait à décourager les (rares) prescripteurs. Il y parvint parfaitement : en dix ans, une centaine d’ATU nominatives de Marinol® fut attribuée…
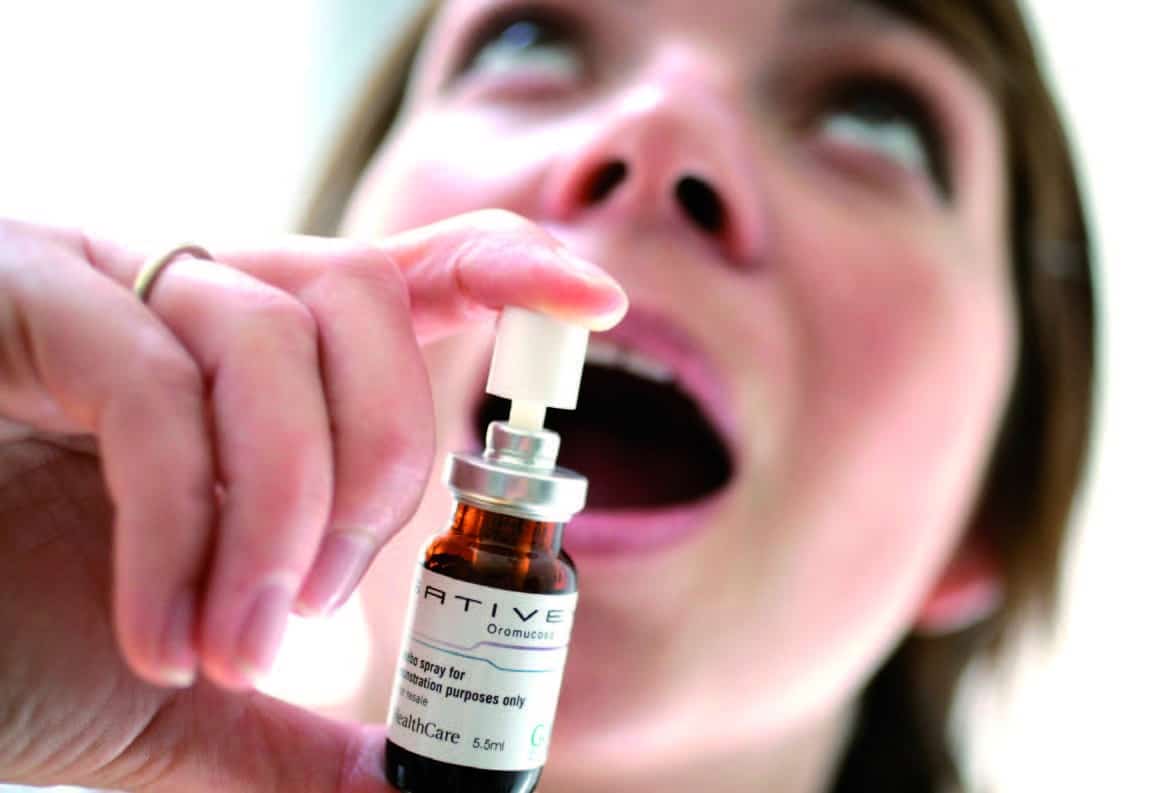
Naïvement, certains tentèrent de savoir pourquoi un autre médicament, le Sativex® dont on parle tant aujourd’hui, ne pouvait pas être prescrit, même dans le cadre contraint de l’ATU nominative. Contrairement au Marinol®, il associe deux cannabinoïdes, le THC, principe psychoactif du cannabis, et le cannabidiol (CBD), qui n’est pas psychoactif. La principale raison de cette association est que le THC seul provoque souvent une anxiété que vient heureusement contrebalancer le CBD. La raison du refus de l’Afssaps était simple mais habituellement ignorée tant l’affaire avait été habilement ficelée : seul le THC de SYNTHÈSE, comme l’indiquait la version du 8 août 2004, pouvait être prescrit. Or le THC et le CBD du Sativex® sont des cannabinoïdes NATURELS, c’est-à-dire extraits de la plante. Bien que n’étant pas psychoactif, le CBD, était en outre exclu de l’ATU !
En février 2013, Marisol Touraine fit connaître son intérêt pour le Sativex® et confia à l’Agence nationale de sécurité du médicament (ANSM, qui a succédé à la défunte Afssaps trop compromise dans le scandale du Médiator®) le soin de mettre en œuvre les conditions d’une AMM pour ce médicament. Le décret du 5 juin 2013 donc l’article R.5181 du CSP qui interdisait l’utilisation du cannabis en médecine depuis cinquante-sept ans.
Une nouvelle usine à gaz ?
Quelle est la morale de cette histoire ? Tout d’abord, on se demande bien pourquoi ce n’est pas Bernard Kouchner, signataire de l’appel du 18 joint de 1976 et sensible à l’utilisation du cannabis dans la douleur, qui a abrogé l’article qui bloquait tout. Ensuite, et l’essentiel est là, on peut poser la question suivante : l’AMM du Sativex® ouvre-t-elle enfin de vraies perspectives pour le cannabis médical, tant sur le plan de la recherche clinique que des indications ou est-on face à une nouvelle usine à gaz qui permettra, tout comme l’ATU nominative du Marinol®, de geler la situation pour les dix prochaines années ?
Le Sativex® n’a actuellement en Europe qu’une seule indication : les contractures douloureuses de la sclérose en plaques et en deuxième intention, c’est-à-dire après que les autres traitements aient échoué. En France, seuls des neurologues hospitaliers pourront en prescrire à des patients adultes avec la possibilité de déléguer la prescription au médecin traitant entre deux consultations hospitalières. Le médicament, qui aura le statut de stupéfiant et dont l’autorisation de prescription sera renouvelée tous les six mois, pourra être délivré en pharmacie de ville2. Et sans entrer dans les détails, le Sativex® sera cher, très cher 3.
Mais les recherches se poursuivent en Europe pour d’autres indications du Sativex®, en particulier dans les douleurs cancéreuses, actuellement en phase 3 d’essais cliniques c’est-à-dire à un stade avancé. Notre beau pays étendra-t-il, au terme du processus, l’indication du Sativex® ? D’une manière plus générale, se contentera-t-il d’un service minimum en queue de peloton ou participera-t-il, sans avoir peur de son ombre, à l’aventure du cannabis et des cannabinoïdes en médecine ? Une déclaration du ministère de la Santé rapportée par Le Monde du 9 janvier 2014 n’est, à cet égard, pas rassurante :
« Il ne s’agit pas de légalisation du cannabis thérapeutique (…) juste d’une autorisation accordée à un médicament. »
Bref, on n’est pas rendu ! Espérons que le ministère fera preuve d’un peu de courage et l’ANSM d’un tout petit peu plus de transparence (Les débats des commissions de mise sur le marché des médicament- et notamment la commission des stupéfiants- sont mis en ligne par le site de l’ANSM à l’adresse suivante : ansm.sante.fr, ce qui est déjà, reconnaissons-le, lui demander beaucoup.
Notes :
1/ ↑ Le ministère français de la Santé vient de faire savoir que le Sativex®, un spray sublingual contenant du THC (tétrahydrocannabinol) et du CBD (cannabidiol) avait obtenu une AMM en France (voir les délibérations de la Commission nationale des stupéfiants du 20 juin 2013). Mis au point à la fin des années 1990 par la société britannique GW Pharmaceuticals et commercialisé au Royaume-Uni en 2005, ce spray est déjà prescrit dans 23 pays, dont 17 en Europe. En France, il pourrait être prescrit de manière très restrictive à partir de 2015 dans les contractures douloureuses de la sclérose en plaques. ↑
2/ ↑ L’AMM obtenue, restent 3 étapes à franchir : celle de la Commission de la transparence de la Haute autorité de santé (HAS) qui déterminera le Service médical rendu (SMR). Le SMR permettra au Comité économique des produits de santé (CEPS) de fixer le prix du médicament. Enfin, l’Union nationale des caisses d’Assurance maladie (UNCAM) déterminera le niveau de remboursement. Au terme de ce processus, le Sativex® pourrait être prescrit à partir du début 2015. Comme je vous le dis ! ↑
3/ ↑ La question du prix du Sativex® a été l’occasion d’un bras de fer entre GW Pharmaceuticals et Almirall, le laboratoire espagnol qui le commercialise en Europe continentale. Puis d’âpres négociations entre Almirall et la Sécurité sociale allemande. L’ANSM considère que le Sativex® concernera 2000 patients, Almirall, 5000. Il n’est pas impossible que cette question du prix soit l’occasion de relations tendues entre les acteurs français du médicament et le laboratoire espagnol. ↑
Ce site utilise Akismet pour réduire les indésirables. En savoir plus sur comment les données de vos commentaires sont utilisées.



Laisser un commentaire